به دلیل اینکه خون یک مایع غیر نیوتونی است، آنالیز دقیق توزیع جریان در شرایط مختلف جریان و ویسکوزیته باید در نظر گرفته شود. توزیع جریان در بستر دانهها به صورت تئوریک با استفاده از معادلات فیزیک – شیمی و شبیه سازی انتقال، مدل سازی میشود. ساختار بستهای(packed) معمولاً پیچیده بوده و در نتیجه الگوی جریان نیز پیچیده است. مسیرهای پرپیچوخمی در فضای بینابینی بستر ذرات جاذب وجود دارد که از کانالهایی با قطرهای متفاوت تشکیل شده است (inter-particle porosity). بستر ذرات جاذب میتواند یک باندل مویرگی را شبیه سازی کند. در بسترهای با فشردگی خوب با مسیرهای پیچدار داخل ذرهای نسبتاً ثابت، تغییرات سرعت جریان در بین هر کانالی نسبتاً کوچک است. به هر حال، اگر فشردگی (packed) همگن و یکنواخت نباشد، کانالها با اندازههای متفاوت منجر به تغییرات معنی داری از سرعت محلول و رکود خون به دنبال مقاومت زیاد در کانالهایی با قطر کوچک و در نتیجه ایجاد لخته میشوند. در مقابل کانالهایی با قطر زیاد به دلیل مقاومت کم به جریان باعث وقوع پدیدۀ ناخواسته preferential flow channeling یا کانالیزه شدن ترجیحی به علت جریان شده که این امر باعث کاهش استفاده بهینه از پتانسیل ذرات جاذب، کاهش جذب و اشباع سریع ذرات جاذب در واحد میشود.
انتقال بینابینی ذره (intra-phase) به صورت انتقال همرفتی مواد از میان ساختار جاذب به دنبال جریان مایع به درون فضای ذرات جاذب است. کیفیت این انتقال نیز به دانسیته بسته، شیب فشار و ضریب نفوذپذیری ذره بستگی دارد.
مکانیسمهای فیزیکی شیمیایی تنظیم سطح جذب چندگانه هستند. هنگامیکه مولکول به سطح جاذب میرسد، مکانیسمهای شیمیایی و فیزیکی متفاوتی را شامل میشود:
۱- نیروهای واندروالسی به وسیلۀ تعامل بین الکترونهای یک مولکول و هستۀ مولکولهای دیگر ایجاد میشود. اینها ضعیف و به طور کلی قابل برگشت هستند.
۲- پیوندهای یونی ایجاد شده توسط جاذبۀ الکترواستاتیکی بین یونهای دارای بار مثبت و بار منفی. اینها نمونهای از رزینهای تبادل یونی هستند.
۳- پیوندهای آب گریز که نشان دهندۀ پیوندهای قوی ناشی از گرایش آب گریز جاذب و مولکولهای مواد ایجاد میشود.

تصویر ۶- مکانیسم های بایندینگ
تکنیکهای رایجی که از سیستم جذب برای تصفیۀ خون استفاده میکنند:
Hemoperfusion (هموپرفیوژن)
تکنیکی است که مادۀ جاذب در یک سیستم خارج بدنی در تماس مستقیم با خون قرار میگیرد. HP سیستم سادهتری نسبت به همودیالیز است ولی به دلیل تماس مستقیم خون با مادۀ جاذب نسبت به همودیالیز نیاز به زیست سازگاری بیشتر و آنتی کواگولاسیون کافی دارد.

تصویر ۷- هموپرفیوژن
بیماریهایی که در ارتباط با تجمع توکسینها هستند اغلب دارای مکانیسم پیچیدهای هستند. این توکسینها مولکولهایی هستند با وزن مولکولی متفاوت از کوچک، متوسط و بزرگ:
۱- توکسینهای کوچک با وزن مولکولی کمتر از ۵۰۰ دالتون
۲- توکسینهای متوسط با وزن مولکولی ۰۰۰⸴۱۰-۵۰۰ دالتون
۳- توکسینهای بزرگ با وزن مولکولی بیشتر از ۰۰۰⸴۱۰ دالتون.
همودیالیز قادر به برداشتن مولکولهایی با وزن مولکولی کمتر از ۰۰۰⸴۵ دالتون، روشهای بر پایۀ جریان همرفت و جذب قادر به برداشت توکسینهایی با وزن بیشتر از ۰۰۰⸴۵۰ دالتون و پلاسمافرزیس قادر به برداشت سمومی تا ۰۰۰⸴۰۰۰⸴۱ دالتون است. برای مثال متابولیتهای مرتبط با اورمی مانند کراتینین و اوره شامل ترکیبات محلول در آب و با وزن مولکولی کم هستند. توکسینهای با وزن مولکولی متوسط مانند parathion, β۲-microglobulin و توکسینهای باند با آلبومین مانند بیلی روبین وp-crassly-sulfate. اینها مولکولهای کوچکی هستند اما عمدتا غیر کووالانسی در پلاسما به آلبومین (۶۶ کیلو دالتون) محدود میشوند. جاذبهای چند منظوره از نظر پزشکی دارای اهمیت بیشتری هستند، زیرا میتوانند همزمان با استفاده از یک درمان کوتاه مدت سموم مختلف سرم با وزنهای مولکولی مختلف را حذف کنند. اما در عمل محصولات موجود دارای روزنههایی هستند که محدودۀ خاصی از مولکولها را برداشت میکنند.
سه روش برای حذف توکسینها توسط مواد جاذب وجود دارد:
- جذبکنندههای متعارف کربن فعال (شارکول)
- رزینهای تبادلکنندۀ یون
- رزینهای تبادلکنندۀ غیر یونی با منافذ بزرگ Macro porous
- برای برداشت توکسینهای دارای وزن مولکولی پایین شارکول فعال و بعضی از رزینهای جاذب hyper-crosslinked بهخوبی مناسب هستند و با داشتن تعداد زیادی میکروپوروس با سطح مخصوص بالا، برای جذب مولکولهای کوچک مناسب هستند. به دلیل اینکه سایز روزنهها کمتر از ۲ نانومتر است در برداشت مولکولهای متوسط و بزرگ مانند سیتوکینها و بتادو میکروگلبولینها محدودیت دارند. در این مورد باید از کارتریجهایی با مکانیسم غربالی و سایز روزنههای بالاتر استفاده شود. با این حال، یک مشکل برای کاهش جذب غیر اختصاصی پروتئینهای پلاسما، به عنوان مثال آلبومین وجود دارد. در مورد برداشت توکسینهای باند با آلبومین، رزینهای مبادله کنندۀ یونی مانند جاذبهای بیلی روبین باید استفاده شود که در این نوع از کارتریجها ممکن است جاذبهای دارای بار الکتریکی مثبت باعث برداشت بعضی از فاکتورهای انعقادی جریان خون شده و موجب اختلالات انعقادی شوند. MARS یا molecular adsorbent recirculating system در نارسایی کبدی مورد استفاده قرار میگیرد. این روش از ۲۰٪ آلبومین استفاده میکند که بطور مداوم در دو ستون در حال گردش است، یکی محتوی شارکول و دیگری مبدل آنیون برای حذف موثر سموم با وزن مولکولی مختلف، به ویژه آنهایی که به آلبومین وصل میشوند.
شارکول یا زغال فعال ظرفیت جذب بالایی مخصوصاً برای مواد محلول در آب و وزن مولکولی کم دارد. تماس مستقیم خون با شارکول بدون لایۀ زیست سازگار توصیه نمیشود. در مقابل یک لایۀ پوششی، به صورت قابل توجهی ممکن است ظرفیت جذبی را به دلیل تاثیر size exclusion محدود کند.
به منظور افزایش انتخاب یک جاذب برای یک توکسین با وزن مولکولی خاص، محققان اغلب اندازۀ منافذ جاذبها را تنظیم میکنند تا بتوان در یک محدودۀ باریک متمرکز شود. با اینحال، یک جاذب با طیف باریک اغلب تنها برای یک ماده خاص با وزن ثابت مولکولی کارآمد است، اما حذف سموم با وزن مولکولی مختلف به طور همزمان با راندمان بالا در یک درمان کوتاه میسر نیست. اخیراً پلیمرهای سنتتیک ظرفیت قابل توجه جذب را برای مصارف بالینی ایجاد کردهاند. روزنههای روی سطوح گرانولار تا حدی بزرگ شدهاند که size exclusion مسالۀ کم اهمیتی شده است. به دنبال پیشرفتهای اخیر، امروزه واحدهای جذب برای HP به صورت مستقیم قابل دسترس شدهاند و تاثیر آن در برداشت سموم، بیلی روبین، سیتوکینها و حتی اندوتوکسینها ثابت شده است.
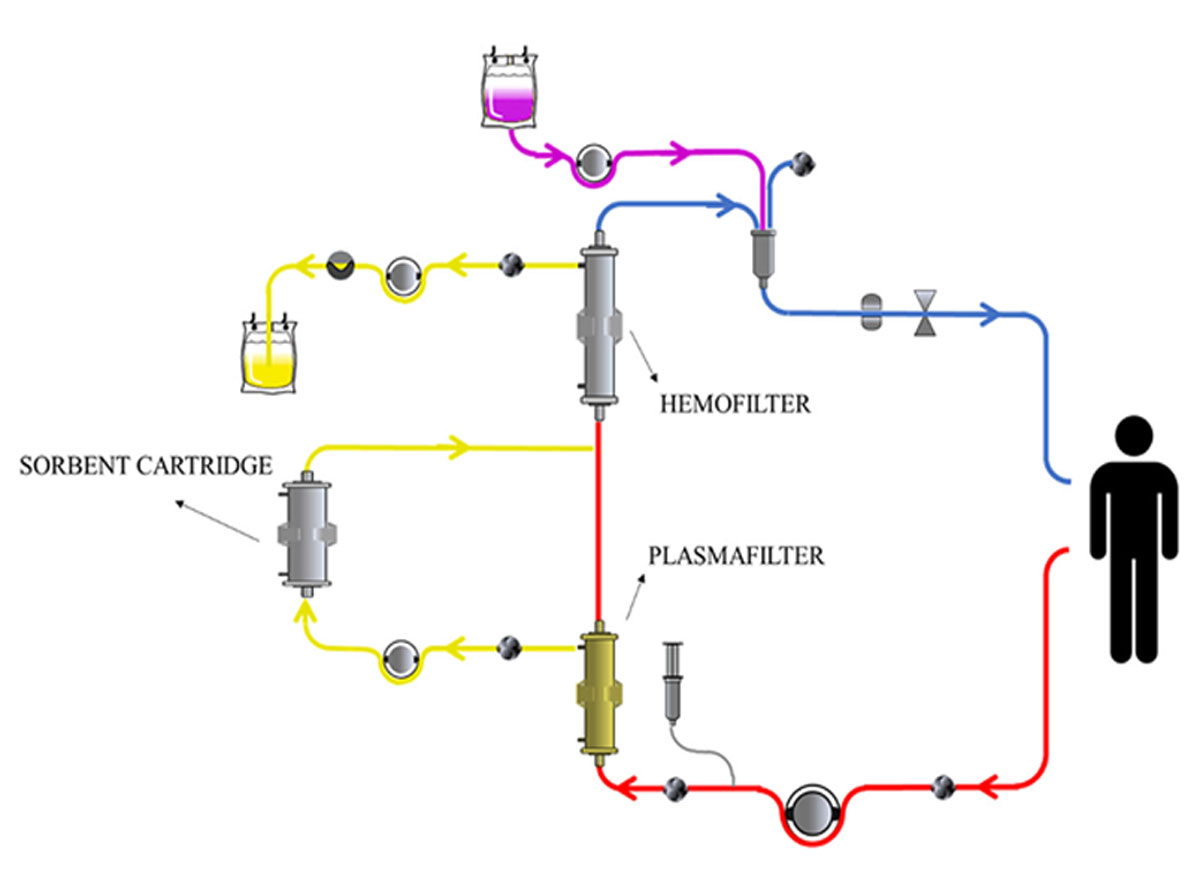
Coupled Plasma Filtration-Adsorption
در این روش تصفیه خون ابتدا پلاسما توسط فیلتر جدا کنندۀ پلاسما از خون کامل جدا میشود و در تماس با جاذب قرار میگیرد. بعد از واحد جذب پلاسما به مسیر گردش خون برگشته و به صورت خون کامل تحت هموفیلتریشن یا همودیالیز قرار میگیرد. امروزه به منظور سهولت کاربرد کیتهای یکبار مصرف آماده استفاده میشود. هدف از روش CPFA تلاش برای برداشت کافی مولکولهای عموما آبگریز است که زیاد توسط هموفیلتریشن یا همودیالیز برداشته نمیشوند. مزیت این روش عدم تماس سلولهای خون با مواد جاذب است و از پلاسما به صورت همزمان و غیرانتخابی واسطههای مرتبط با سپسیس بدون نیاز به پلاسمای اهدایی برداشت میشود. استفادۀ گسترده از این تکنیک در بیماران مبتلا به سپسیس موجب بهبودی علایم حیاتی و تعدیل فعالیت سیستم ایمنی شده است.

تصویر ۸- فیلتراسیون پلاسما
مراجع
- William R. Clark. Fiorenza Ferrari. Gaetano La Manna. Claudio Ronco.Extracorporeal Sorbent Technologies: Basic Concepts and Clinical Application. Contrib Nephrol. Basel, Karger, 2017, vol 190, pp 43–۵۷
- Jian Chen. High performance of a unique mesoporous polystyrene-based adsorbent for blood purification. Regenerative Biomaterials, 2016, 1–۷٫
- Yajie Li. Design, Fabrication and Application of Polymeric Porous Media. ParisTech. 2018.
- Johannes Carolus Jansen, Elisa Esposito, Alessio Fuoco, Mariolino Carta. Microporous Organic Polymers: Synthesis,Characterization, and Applications. Polymers 2019, 11, 844